| 站内搜索: |
| 中国案例 |
| 质量 | 信誉 | 决策与管理 | 不公平竞争 | 违法违规 |
| 匹多莫德事件背后:审批宽松成“万金油”,或有神药被挖出 |
|
客家经济网 2018 年 4 月 18 日 16 时 22 分 19 秒 来源: 南方都市报 2018-3-18 10:44:00 |
|
原标题:匹多莫德事件背后:审批宽松成“万金油”,或有神药被挖出 儿科 神药”匹多莫德 三岁以下禁用 出镜率极高的“神药” 3月9日,当听到《修订匹多莫德制剂说明书的公告》发布时,冀连梅的手一直在颤抖,因为“激动和兴奋!这些日子承受的压力在此刻终于可以释放了”。 三个月前,冀连梅还不知道“神药”匹多莫德为何物。 在她开的微信平台“问药师”平台上,几乎每天都能看到关于这个药的咨询。但在她所工作的诊所里,九年时间,从未采购过这款药品。这引起了她的好奇,匹多莫德到底是一款什么药?
“问药师”平台上关于匹多莫德的咨询。 她随手在平台上一搜,才意识到这个药是儿科、耳鼻喉科和皮肤科医生的宠儿。 “从这三个科室看完病出来的孩子,几乎每人手里的药单上都有匹多莫德的身影,流水线一般——预防感冒来一盒、发烧咳嗽来一盒、鼻炎扁桃体炎来一盒、湿疹荨麻疹来一盒……!每盒的单价从几十到上百元不等,而且一开就是一个月的量,一吃就是三个月的疗程。”冀连梅写道。 冀连梅在网上检索到的数据显示,2016年,匹多莫德在国内等级医院销售额达到了35亿,在零售药店的销售额是4.27亿,再加上在其他非等级医院的销售额,总额很可能达到40亿,这其中,绝大多数由儿童患者买单。 当然,家长最担心的是用药安全,他们不断向冀连梅咨询,后者于是开始研究这款药。 “神药”疗效并不明确 冀连梅一研究才发现,原来这款出镜率极高的“神药”,疗效并不明确。 在匹多莫德的外包装上,适应症一栏标注为,“适用于机体免疫功能低下患者的上下呼吸道反复感染(咽炎、气管炎、支气管炎等);耳鼻喉科反复感染(鼻炎、扁桃体炎、鼻窦炎、中耳炎);泌尿系统感染;妇科感染;并可用于预防急性感染,缩短病程,减少疾病的严重程度;可作为急性感染期的辅助用药。” 这让冀连梅深感困惑。她认为,匹多莫德所标注的适用范围,已经达到“万金油”程度,临床上并不科学。
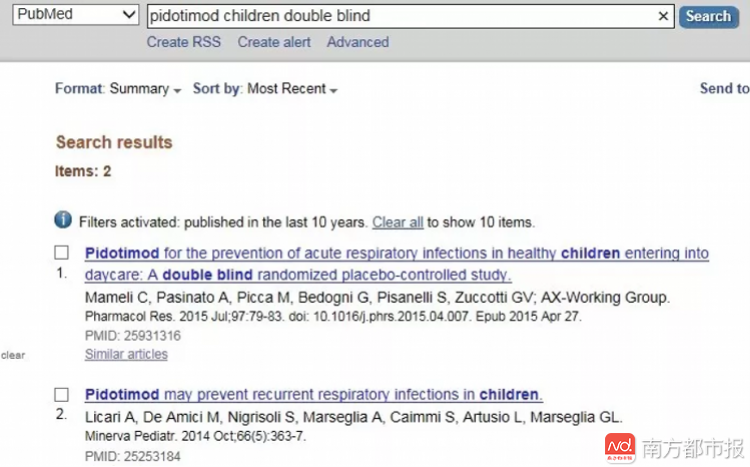
医学数据库Pubmed上,匹多莫德的儿童双盲实验论文只有2篇。 据冀连梅查询,这种药1993年首次在意大利上市,距今已有24年的临床使用历史,但通过查询国际知名医学数据库Pubmed网站和询证医学数据库考科兰(Cochrane)网站发现,平台检索结果均不足100篇文献,而且集中在俄罗斯、意大利、中国等少数几个国家,且排名靠前的文章仍然停留在动物研究阶段,对临床实际指导意义不大。 而当冀连梅在国内数据库搜索时,结果让她“惊呆了”,光是CNKI数据库就弹出1400+条文献,其中不乏许多核心期刊。 更让她吃惊的是,研究结果几乎清一色是阳性结果。这些结果表明匹多莫德对反复呼吸道感染、哮喘、泌尿系统感染、妇科感染、丙型肝炎,甚至是非感染性疾病如白癜风、肿瘤、过敏性紫癜等病均有较好的预防或治疗效果。 “简直是万能神药!我很希望这是真的,这将意味着很多不治之症有了重生的希望!”冀连梅写道。 但当她仔细研读了国内这些文献,发现这些研究的循证证据等级都不高,可以肯定地说,国内同样缺乏高质量可靠临床研究证实匹多莫德的有效性和安全性。 南都记者以匹多莫德英文名“Pidotimod”查阅了美国食品药品监督管理局和欧洲药品管理局官网,并没有发现该药品的注册信息,也就是说,尽管匹多莫德在意大利上市,但没有得到欧盟的认可,目前仅在少数国家上市。 值得一提的是,这款药于2016年在巴基斯坦上市时,也因为没有被收录到任何一本标准的药理学教材中,也没有被欧盟药品监管部门EMA和美国药品监管部门FDA批准上市,有效性和安全性仍需进一步的评估,不推荐上市使用。 药厂声称要告冀连梅 冀连梅的文章一经发布,立刻在家长和医药行业中引发轩然大波。 南都记者采访了多位幼儿家长,均表示半年之内在医院开过匹多莫德片剂或口服液,因为是医生开的处方药,他们均表示按医嘱服用。 一位家长在冀连梅的文章下面回复道,“回老家二三线城市居然很普遍,姥姥给外孙找熟人买的药,我也没好意思拒绝,但是并没有给小孩喝,上网查了好多回,一直在纠结。今天看了您的文字,彻底明白了。” 医药行业也受到这篇文章的影响。国内生产匹多莫德的药厂中,江苏吴中作为上市公司,在上海证券交易所互动平台上对公众解答了相关质疑。 “公司匹多莫德这个产品是经过国家药监局严格审批后拿到生产批件,并严格按照国家GMP认证要求生产出符合国家质量标准的产品。至于该产品临床情况怎样,只有使用过的医生及相关专家最有发言权,相信他们的观点及发表的文章是经过对该药品临床数据收集、统计分析后形成的,具有循证医学的依据。公司将视该事项的实际进展及产生的影响,采用相应的手段维护自身利益。”江苏吴中在上海证券交易所互动平台中回应。 冀连梅的文章也受到了不少医疗界人士的质疑,有人认为她的论证方式存在很大漏洞。对此,冀连梅回应:“从科学论证的角度来说,如果说我的检索过程不合适,有问题,应该举例反驳。实际上到目前为止,也没有这种明确的例证,来证明我的检索调查过程有瑕疵。” 甚至,有些药厂的人称要投诉、起诉她。冀连梅感觉到压力很大,曾有两天没去上班,甚至怀疑做这件事的意义。
国家食药监总局发公告要求对匹多莫德说明书进行修订。 3月9日,国家食药监总局公告称,所有匹多莫德制剂生产企业均应依据《药品注册管理办法》等有关规定,按匹多莫德制剂说明书模板,提出修订说明书的补充申请,于2018年4月30日前报省级食品药品监管部门备案。 修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在补充申请备案后6个月内对所有已出厂的药品说明书及标签予以更换。说明书修改地方包括“本品可用于3岁及以上儿童及青少年患者,3岁以下儿童禁用”等。 在此之前,匹多莫德的说明书适用于所有年龄阶段。 来自国家食药监总局的公告终于让冀连梅“奔走相告、喜极而泣”。同时,从质疑到说明书修改也让她身心俱疲。 “我不再回复这个药的问题了,谢谢理解。”冀连梅对南都记者说。 业内人士:类似“神药”还有不少 冀连梅的“胜利”,在不少业内人士看来,是偶然中的必然。 匹多莫德能通过审批上市,有其历史原因。曾有一段时期,为了推动更多药品尽快上市,只要按照药品审评的要求,把各项材料报上去,很容易就批下来了,甚至有的药企造假数据过关。 这样的做法导致有的药品上市,数据却不真实,也引发了后来被医药界广为流传的“722医药界惨案”——药物临床试验数据自查核查。
国家食药监总局要求开展药物临床试验数据自查核查。 2015年7月22日,国家食品药品监管总局要求所有已申报并在总局待审的药品注册申请人,均须按照《药物临床试验质量管理规范》等相关要求,对照临床试验方案,对已申报生产或进口的待审药品注册申请药物临床试验情况开展自查,确保临床试验数据真实、可靠,相关证据保存完整。甚至要“将弄虚作假的申请人、临床试验机构、合同研究组织以及相关责任人员等列入黑名单。” 在医药界人士看来,这是在为曾经宽松审批药品的历史“补课”。 “比如匹多莫德,其实本来是个辅助用药,审批时却做成了治疗类药品。医生在临床中逐渐发现,这个药品没有说明书中的效果,包括莎普爱思也是这样。现在医生说匹多莫德缺乏临床数据,可在审批时是肯定有的,至于当时数据是怎么来的,就不清楚了。”第三方医药服务平台麦斯康莱创始人史立臣对南都记者说。 史立臣表示,正是因为有些药品没效果,医生才敢大量启用,如果一款药疗效很好,医生根本不敢随便开。 “就像青霉素,效果立竿见影,只能按照用量严格使用。”史立臣说。 除了对药物临床数据进行自查核查,2016年3月5日,国务院办公厅还印发了《关于开展仿制药质量和疗效一致性评价的意见》,国家食品药品监督管理总局在对该文件进行政策解读时也曾表示,“对已经批准上市的仿制药进行一致性评价,这是补历史的课。因为过去我们批准上市的药品没有与原研药一致性评价的强制性要求,所以有些药品在疗效上与原研药存在一些差距。” “莎普爱思和匹多莫德这两件事一出来,以后还有更多"神药"会被挖掘出来。”史立臣对南都记者说。 采写:南都记者 申鹏 |
相关文章